高中化学知识点:一次电池
逍遥右脑 2016-04-22 08:45
电源:
化学电源化学电源是能够实际应用的原电池,化学电池是将化学能转变成电能的装置,它包括一次电池、二次电池和燃料电池等几大类。
一次电池:
(1)普通锌锰干电池构造简单,价格便宜,但放电时间短,放电后电压下降较快。
负极:
正极: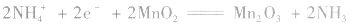
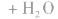
总反应式: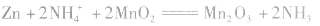
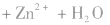
(2)碱性锌锰电池比普通锌锰干电池性能优越,比能量和可储存时间均有提高,适用于大电流和连续放电。负极是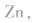 正极是
正极是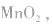 电解质是
电解质是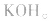
负极: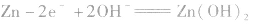
正极:
总反应式: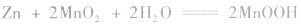
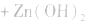
(3)锂电池
用金属锂作负极,石墨作止极,电解质溶液由四氯化铝锂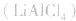 溶解在亚硫酰氯
溶解在亚硫酰氯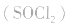 组成。
组成。
负极:
正极:
总反应式: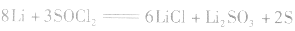
(4)锌银电池
负极是Zn,正极是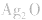 ,电解质是KOH。
,电解质是KOH。
负极: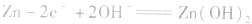
正极: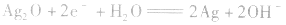
总反应式:
这种电池比能量大,电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式微型电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
相关高中化学知识点:原电池电极反应式的书写
原电池电极反应式的书写:
(1)以铜锌原电池为例:
负极(Zn):Zn-2e-=Zn2+
正极(Cu):2H++2e-=H2↑
(2)正负极反应式的书写技巧:
①先确定原电池的正负极,在两极的反应物上标出相同数目的电子得失。
②根据物质放电后生成物的组成和电解质溶液中存在的离子,找到电极反应中还需要的其它离子。此时要注意溶液的酸碱性,从而判断应该是H+、OH-还是H2O参与了反应。因Zn反应后生成了Zn(OH)2,而KOH为电解质,可知负极上OH-参与了反应。MnO2生成了MnO(OH),即增加了氢元素,可知正极上有水参与了反应。
③根据电子守恒和电荷守恒写出电极反应式,即要注意配平和物质的正确书写形式,应按照离子方程式的书写要求进行。②中反应的电极反应式为:
负极:Zn+2OH--2e-=Zn(OH)2 正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(若只要求写正极的反应式,也可以写成MnO2+H2O+e-=MnO(OH)+OH-)
原电池总反应式的书写:将正负电极反应相加,即为原电池总反应式。
原电池正、负极的判断方法:
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法有以下几种。
1.由组成原电池的两极材料判断一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断在外电路,电流由正檄流向负极;电子由负极流向正极
3.根据原电池里电解质溶液中离子的定向移动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
4.根据原电池两极发生的变化来判断原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
5.X极增重或减轻工作后,X极质量增加,说明X极有物质析出,X 极为正极:反之,X极质量减少,说明X极金属溶解,X 极为负极
6.X极有气泡冒出工作后,x极上有气泡冒出,一般是发生了析出H,的电极反应,说明x极为正极。
7.X极附近pH的变化析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。
8.特例在判断金属活泼性的规律中,有一条为“当两种金属构成原电池时,活泼金属作负极,不活泼金属作正极”,但这条规律也有例外情况,如Mg和Al为原电池的两极,KOH为电解质溶液时,虽然Mg比Al活泼,但因Mg不和KOH反应,所以Mg作原电池的正极等。
相关高中化学知识点:原电池原理
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:
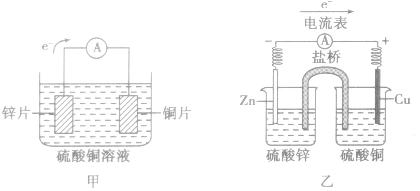
(2)原理图:
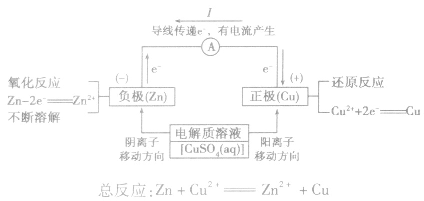
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
相关高中化学知识点:燃料电池
燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电池。
(1)氧氧燃料电池以氢气为燃料(作负极),以氧气为氧化剂(作正极),可用酸性电解质(如稀H2SO4),也可用碱性电解质(如KOH)。
①若电解质是酸性的,在电极反应式中不能出现OH-。
负极:
正极: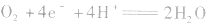
总反应式:
②若电解质是碱性的,在电极反应式中不能出现H+。
负极: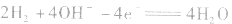
正极: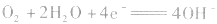
总反应式:
(2)甲烷一氧气燃料电池
若将金属铂片插入KOH溶液中作电极,在两极上分别通入甲烷和氧气。
负极: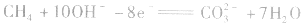
正极: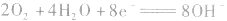
总反应式:
新型化学电源的考查及解题指导:
近几年高考试题中出现的新型电池,有“氢镍电池”“高铁电池”“锌一锰碱性电池”、我国首创的“海洋电池”“燃料电池”(如新型细菌燃料电池、CO燃料电池)、“锂离子电池”“银锌电池~纽扣电池”等。这些电池一般具有高能环保、经久耐用、电压稳定、比能量 (单位质量释放的能量)高等特点。取材于这些知识点的试题,由于题材广、信息新、陌生度大,所以,大多数考生认为这类试题难度大,而难在何处又十分迷茫。实际上这些题目主要考查的是学生对信息的迁移应用能力。具体有以下几个考查角度:
1.新型电池“放电”时正、负极的判断
2.新型电池“放电”时,电极反应式的书写首先根据电池反应分析物质得失电子情况,然后再考虑电极反应生成的物质是否跟电解质溶液巾的离子发生反应;对于较复杂的电极反应,可以利用总反幢方程式减去较简单一极的电极反应式,从而得到较复杂一极的电极反应式。
3.新型电池“充电”时阴、阳极的判断首先明确原电池放电时的正、负极,再根据充电时,阳极接正极、阴极接负极的原理进行分析。
4.新型电池充、放电时,电解质溶液中离子移动方向的判断首先分清电池是放电还是充电;再判断正、负极或阴、阳极,进而可确定离子的移动方向。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件至 lxy@jiyifa.cn 举报,一经查实,本站将立刻删除。