初中化学计算题解题一定要扣准这三方面!
逍遥右脑 2018-09-08 14:03
昨天同学留言说有关化学反应方程式的综合应用题(也就是计算题)不知道如何去下手,其实计算题解题方法扣住下面三点就能解决!
初中化学计算题解题方法
解计算题一定用到以下三个知识点:
一、质量守恒定律
1. 理解质量守恒定律抓住“五个不变”、“两个一定改变”及“一个可能改变”,即:
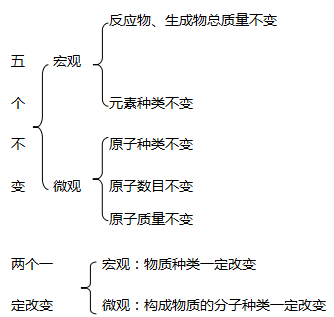
一个可能改变:分子总数可能改变
2 运用质量守恒定律解释实验现象的一般步骤为:
(1) 说明化学反应的反应物、生成物;
(2) 根据质量守恒定律,应该是参加化学反应的各物质质量总和等于各生成物质量总和;
(3) 与题目中实验现象相联系,说明原因。
3.应用质量守恒定律时应注意:
(1)质量守恒定律只能解释化学变化而不能解释物理变化;
(2)质量守恒只强调“质量守恒”不包括分子个数、体积等方面的守恒;
(3)“质量守恒”指参加化学反应的各物质质量总和和生成物的各物质质量总和相等,不包括未参加反应的物质的质量,也不包括杂质。
二、化学方程式
1. 化学方程式的书写步骤
(1) 写:正确写出反应物、生成物的化学式
(2) 配:配平化学方程式
(3) 注:注明反应条件
(4) 标:如果反应物中无气体(或固体)参加,反应后生成物中有气体(或固体),在气体(或固体)物质的化学式右边要标出“↑”(或“↓”).
若有气体(或固体)参加反应,则此时生成的气体(或固体)均不标箭头,即有气生气不标“↑”,有固生固不标“↓”。
2.根据化学方程式进行计算的步骤
(1) 设:根据题意设未知量
(2) 方:正确书写有关化学反应方程式
(3) 关:找出已知物、待求物的质量关系
(4) 比:列出比例式,求解
(5) 答:简要的写出答案
3、有关化学方程式计算的常用公式
(1)气体密度(标准状况下)的计算式
(2)不纯物质中某纯物质的质量的计算式
某纯物质的质量(g)=不纯物质的质量(g)×该物质的质量分数
(3)由纯物质的质量求不纯物质的质量的计算式
(5)混合物中表示组分质量分数的计算式
(6)产率、利用率的计算式
原料损耗率%=1-原料利用率(转化率)
4、化学方程式计算的解题要领可以归纳为:
化学方程式要配平,需将纯量代方程;
量的单位可直接用,上下单位应相同;
遇到有两个已知量,应找不足来进行;
遇到多步的反应时,关系式法有捷径。
三、有关溶液的计算
1.应熟练掌握本部分常用的计算公式和方法
溶质质量
公式一:溶质的质量分数=—————————×100%
溶液质量
溶质质量
=————————— ×100%
溶质质量?溶剂质量
公式二: 溶质的质量分数与溶液密度、体积的有关换算
溶质质量
溶质的质量分数= ———————— ×100%
溶液体积(V)×溶液密度(p)
公式三:溶液稀释的计算
m1×w1= m 2×w2
m1、m2——稀释前后溶液质量;
w1、w2——稀释前后溶液中溶质的质量分数。
2. 有关溶液与化学反应方程式结合起来的综合题,
如将一种物质M加入到两种物质的混合物中,与其中一种物质A恰好完全反应,生成物是两种混合物中的另一种物质B,求所得溶液中溶质的质量分数时,溶质、溶液的质量分别为:
(1)、溶质的质量=生成物B的质量+原混合物中B的质量。
(2)、反应后溶液的总质量=物质M的质量+两种混合物(或固体,或溶液)的质量-沉淀(或气体、或杂质)的质量。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件至 lxy@jiyifa.cn 举报,一经查实,本站将立刻删除。