高中化学知识点:粒子浓度大小的比较
逍遥右脑 2018-03-29 15:54
离子浓度大小比较方法:
(1)考虑水解因素:如 溶液
溶液 
所以
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为:
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中: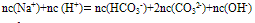
推出: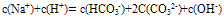
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: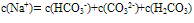
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: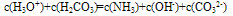
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 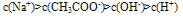
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
相关高中化学知识点:沉淀溶解平衡
沉淀溶解平衡:
1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:

2、沉淀溶解平衡的特征:
(1)逆:沉淀溶解平衡是可逆过程。
(2)等:

(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,
(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但
 不变。
不变。 b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时
 变大。
变大。 c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但
 不变。
不变。 d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,
 不变。
不变。沉淀溶解平衡的应用:
1.沉淀的生成
(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使 转变为
转变为 沉淀而除去。
沉淀而除去。 
b.加沉淀剂法:如以 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如 等生成极难溶的硫化物
等生成极难溶的硫化物
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。
说明:化学上通常认为残留在溶液中的离子浓度小于 时即沉淀完全。
时即沉淀完全。
2.沉淀的溶解
(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使 平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法
a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。如向 沉淀中加入
沉淀中加入 溶液,
溶液, 结合生成
结合生成 使
使 的溶解平衡向右移动。
的溶解平衡向右移动。
b.生成配合物:加入适当的物质,使其与沉淀反应生成配合物。
如:

c.氧化还原法:加入适当的物质,使其与沉淀发生氧化还原反应而使沉淀溶解。


d.沉淀转化溶解法:本法是将难溶物转化为能用上述三种方法之一溶解的沉淀,然后再溶解:
如向 中加入饱和
中加入饱和 溶液使
溶液使 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。
3.沉淀的转化
(1)实质:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。例如
(2)沉淀转化在工业上的应用在工业废水处理的过程中,用FeS等难溶物作沉淀剂除去废水中的重金属离子.
固体物质的溶解度:
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。不同的固体物质在水中的溶解度差别很大,可将物质进行如下分类:
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件至 lxy@jiyifa.cn 举报,一经查实,本站将立刻删除。